気管支喘息は早期より実地診療にガイドラインが導入された疾患の一つです。吸入ステロイド剤の積極的使用により、この20年間で劇的に入院患者数、死亡率が減少し臨床的に最も成功を治めた呼吸器疾患といえます。しかしながら、吸入ステロイド剤を用いてもコントロール不良な症例が存在しており、気道のリモデリングが原因と考えられるようになりました。現在使用される薬剤で気道リモデリングの進展阻止、また一旦起こったリモデリングを改善させる薬剤はなく新規薬剤の開発が期待されています。
アレルギーグループでは、首尾一貫して気管支喘息をターゲットに研究を行ってきた。これまでの研究は気道上皮細胞をターゲットとしたin vitroの研究の時代から気管支喘息モデルマウスを用いたin vivoの研究の時代の2つにまとめることができる。
1.気道上皮細胞機能解析
気道上皮細胞のcell lineであるBEAS-2B細胞および気管支鏡を用いヒトより採取した気道上皮細胞を用いて、気道炎症における役割を検討しています。その結果、気道上皮細胞がTh2サイトカインにより好酸球に関連の深いGM-CSF、Th2リンパ球の遊走に関与するRANTESを産生し、気道炎症に積極的に関与していることを明らかにしました(
Nakamura Y et al. Am J Respir Cell Mol Biol, 1996)。
以後、気道上皮細胞の多様な作用について検討をしています。その中で気道上皮細胞にHLA-DRやICAM-1など抗原提示に関わる表面抗原があることを確認し、更に気道上皮細胞に抗原提示能が備わっていることを報告しました(
Tanaka H et al. J Med Invest, 2001)。GM-CSFおよびIL-8産生の調節機構として、HRF (IgE dependent histamine releasing factor) p23が気道上皮細胞からのGM-CSF、IL-8産生を刺激することを見出し、更に臨床検体を用いた解析で気管支肺胞洗浄液中のHRF p23が健常人と比し喘息患者気道でより高濃度であることを併せて報告しました(
Yoneda K et al. Am J Physiol Lung Cell Mol Physiol, 2004)。
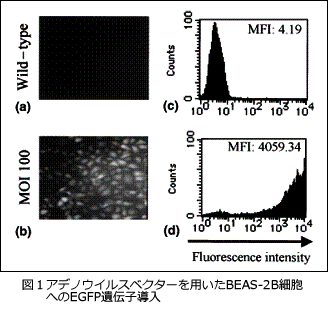
治療的観点からTh1/Th2サイトカインのバランスを考えた場合、Th1サイトカインによるアレルギー抑制の可能性が考えられます。Th1サイトカインであるIL-12により末梢血単核球からの好酸球増多に関わるGM-CSF産生が抑制されることを報告しました(B>Okano Y et al.
Int Arch Allergy Immunol, 1998)。そこで、より直接的な治療として気道上皮細胞を中心としたTh1シフトを誘導するため、ウイルスベクターを用いて気道上皮細胞へのIL-12の遺伝子導入を試みました。その結果、アデノウイルスベクターを用いることで気道上皮細胞へのIL-12遺伝子導入に成功しました(
Ogawa H et al. Clin Exp Allergy, 2003)(図1)。
また、私たちのグループにおいてクローニングしたHuman airway trypsin-like protease(HAT)についても、生理的あるいは疾患における役割の解析を進めています(
Yasuoka S et al. Am J Respir Cell Mol Biol, 1997; J Biol Chem, 1998)。
2.In vitroからin vivoへの展開

トランスレーショナルリサーチを目指し、更なる展開のため気管支喘息の動物モデルの作成が望まれます。そこで、マウスの卵白アルブミン(OVA)による急性炎症モデルを作成し、次にヒトのアレルゲンとして臨床的にも重要なダニ抗原(Dp)を用いた慢性モデルの作成に取り組みました。その結果、ダニ抗原吸入刺激を8週間行う慢性モデルを作成し、気管支基底膜下の線維化、気管支平滑筋の肥厚、気道上皮の杯細胞化成等の気道リモデリングを直接評価することが可能となりました(図2)。
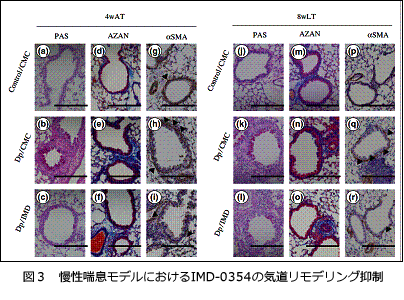
そこで、本モデルを用いて難治性喘息に対する新たな治療法の開発研究を開始した。転写因子であるNF-kBは、炎症病態に深く関わっており喘息を含めた多くの疾患で治療のターゲットと考えられていたことから、NF-kB阻害剤(IMD-0354)の新規治療薬としての可能性について検討を行った。IMD-0354は、OVA急性炎症モデルにおいてアレルギー性炎症、気道過敏性の抑制効果を(Sugita A et al. Int Arch Allergy Immunol 2009)、Dp慢性モデルにおいて気道リモデリング抑制効果と気道リモデリング改善効果を示し新規喘息治療薬の候補となることを報告しました(Ogawa H et al. Clin Exp Allergy 2011) (図3)。
更に神経原性炎症の観点から気道過敏性と局所のNGF(nerve growth factor)濃度とに相関があることを明らかにし、siRNAによるNGF抑制による気管支喘息治療の可能性を示しました(
Ogawa H et al. Clin Exp Allergy, 2012)。また、TARC-PE38(ケモカインであるTARCに緑膿菌の菌体外毒素を結合させたchemotoxin)を用いTh2細胞を選択的に破壊することによる治療効果についても報告しています。
当グループの現在の研究は、良性肺疾患グループがずっとテーマにしてきた肺の線維化抑制と同様に気道リモデリングという局所の線維化抑制を目指しています。新たな喘息病態の解明と治療法の開発を目指したいと考えています。
 治療的観点からTh1/Th2サイトカインのバランスを考えた場合、Th1サイトカインによるアレルギー抑制の可能性が考えられます。Th1サイトカインであるIL-12により末梢血単核球からの好酸球増多に関わるGM-CSF産生が抑制されることを報告しました(B>Okano Y et al. Int Arch Allergy Immunol, 1998)。そこで、より直接的な治療として気道上皮細胞を中心としたTh1シフトを誘導するため、ウイルスベクターを用いて気道上皮細胞へのIL-12の遺伝子導入を試みました。その結果、アデノウイルスベクターを用いることで気道上皮細胞へのIL-12遺伝子導入に成功しました(Ogawa H et al. Clin Exp Allergy, 2003)(図1)。
治療的観点からTh1/Th2サイトカインのバランスを考えた場合、Th1サイトカインによるアレルギー抑制の可能性が考えられます。Th1サイトカインであるIL-12により末梢血単核球からの好酸球増多に関わるGM-CSF産生が抑制されることを報告しました(B>Okano Y et al. Int Arch Allergy Immunol, 1998)。そこで、より直接的な治療として気道上皮細胞を中心としたTh1シフトを誘導するため、ウイルスベクターを用いて気道上皮細胞へのIL-12の遺伝子導入を試みました。その結果、アデノウイルスベクターを用いることで気道上皮細胞へのIL-12遺伝子導入に成功しました(Ogawa H et al. Clin Exp Allergy, 2003)(図1)。 トランスレーショナルリサーチを目指し、更なる展開のため気管支喘息の動物モデルの作成が望まれます。そこで、マウスの卵白アルブミン(OVA)による急性炎症モデルを作成し、次にヒトのアレルゲンとして臨床的にも重要なダニ抗原(Dp)を用いた慢性モデルの作成に取り組みました。その結果、ダニ抗原吸入刺激を8週間行う慢性モデルを作成し、気管支基底膜下の線維化、気管支平滑筋の肥厚、気道上皮の杯細胞化成等の気道リモデリングを直接評価することが可能となりました(図2)。
トランスレーショナルリサーチを目指し、更なる展開のため気管支喘息の動物モデルの作成が望まれます。そこで、マウスの卵白アルブミン(OVA)による急性炎症モデルを作成し、次にヒトのアレルゲンとして臨床的にも重要なダニ抗原(Dp)を用いた慢性モデルの作成に取り組みました。その結果、ダニ抗原吸入刺激を8週間行う慢性モデルを作成し、気管支基底膜下の線維化、気管支平滑筋の肥厚、気道上皮の杯細胞化成等の気道リモデリングを直接評価することが可能となりました(図2)。
 そこで、本モデルを用いて難治性喘息に対する新たな治療法の開発研究を開始した。転写因子であるNF-kBは、炎症病態に深く関わっており喘息を含めた多くの疾患で治療のターゲットと考えられていたことから、NF-kB阻害剤(IMD-0354)の新規治療薬としての可能性について検討を行った。IMD-0354は、OVA急性炎症モデルにおいてアレルギー性炎症、気道過敏性の抑制効果を(Sugita A et al. Int Arch Allergy Immunol 2009)、Dp慢性モデルにおいて気道リモデリング抑制効果と気道リモデリング改善効果を示し新規喘息治療薬の候補となることを報告しました(Ogawa H et al. Clin Exp Allergy 2011) (図3)。
更に神経原性炎症の観点から気道過敏性と局所のNGF(nerve growth factor)濃度とに相関があることを明らかにし、siRNAによるNGF抑制による気管支喘息治療の可能性を示しました(Ogawa H et al. Clin Exp Allergy, 2012)。また、TARC-PE38(ケモカインであるTARCに緑膿菌の菌体外毒素を結合させたchemotoxin)を用いTh2細胞を選択的に破壊することによる治療効果についても報告しています。
そこで、本モデルを用いて難治性喘息に対する新たな治療法の開発研究を開始した。転写因子であるNF-kBは、炎症病態に深く関わっており喘息を含めた多くの疾患で治療のターゲットと考えられていたことから、NF-kB阻害剤(IMD-0354)の新規治療薬としての可能性について検討を行った。IMD-0354は、OVA急性炎症モデルにおいてアレルギー性炎症、気道過敏性の抑制効果を(Sugita A et al. Int Arch Allergy Immunol 2009)、Dp慢性モデルにおいて気道リモデリング抑制効果と気道リモデリング改善効果を示し新規喘息治療薬の候補となることを報告しました(Ogawa H et al. Clin Exp Allergy 2011) (図3)。
更に神経原性炎症の観点から気道過敏性と局所のNGF(nerve growth factor)濃度とに相関があることを明らかにし、siRNAによるNGF抑制による気管支喘息治療の可能性を示しました(Ogawa H et al. Clin Exp Allergy, 2012)。また、TARC-PE38(ケモカインであるTARCに緑膿菌の菌体外毒素を結合させたchemotoxin)を用いTh2細胞を選択的に破壊することによる治療効果についても報告しています。