
良性肺疾患グループの研究は、
間質性肺炎・肺線維症を中心とした間質性肺疾患の新たな治療戦略の開発が目的です。特に、進行性の肺機能低下を特徴とする難病指定疾患、特発性肺線維症(IPF)を重要な研究対象としています。現在IPFに対しては、従来から使用されてきたステロイドや免疫抑制薬による治療の有効性が否定され、肺胞上皮細胞と線維芽細胞を中心とした線維化仮説に基づき新たな抗線維化薬の開発が望まれています。
私たちのグループでは、ブレオマイシン(BLM)を用いた肺線維症モデルマウスを中心に、個体レベルでの線維化メカニズムの解析を行うと同時に、これらの研究成果を応用した新たな抗線維化療法の開発を目指しています。
ここでは、これまでの私たちの研究の歩みについて、ご紹介したいと思います。良性肺疾患グループの研究に興味をもち、当グループで研究をしたいという方がおられましたら、
当教室まで御連絡ください。
1.増殖因子阻害薬の開発研究(イマチニブ・ニンテダニブ・TAS-115)
IPFの病態生理の本態は線維性組織の異常増殖であり、その主たる役割を担う肺線維芽細胞の増殖・分化には様々な増殖因子が関与しています。中でもPDGF(血小板由来増殖因子)は主要な増殖因子として知られています。
私たちは、2000年代初頭、当時がん領域で急速に開発が進んでいた分子標的治療薬に注目し、研究を開始しました。もし、分子標的治療薬の中に抗線維化作用を有する薬剤が存在すれば、IPFに対する適応拡大を行うことにより、比較的短期間でIPF治療薬の開発に結び付くことが期待されたためです。
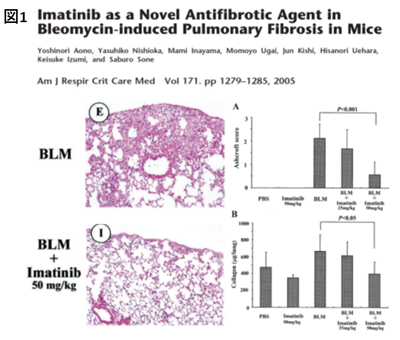
各種の分子標的治療薬のスクリーニングを行った結果、私たちは最初の分子標的治療薬として開発された慢性骨髄性白血病の治療薬であるイマチニブには、フィラデルフィア染色体であるBcr-Ablのみならず、肺線維芽細胞の増殖因子であるPDGF受容体の阻害活性を有していることに着目し、その抗線維化効果を検討しました。その結果、イマチニブは肺線維芽細胞の増殖を抑制することで強力な抗線維化作用を示しました(
Aono Y et al. Am J Respir Crit Care Med. 2005)(図1)。
また同時に、肺線維症で増加する血清中のα1-acid glycoprotein (AGP)がイマチニブに結合し、イマチニブの耐性化を引き起こすことをも見出し、報告しました(
Azuma M et al. Am J Respir Crit Care Med. 2007)。実際にAGPはIPF患者血清中で増加しており、臨床においてもイマチニブ耐性を引き起こす可能性が示唆されました。その後、米国でイマチニブによるIPFの臨床試験が行われましたが、残念ながら結果はnegativeであり、AGPによる阻害作用が原因であった可能性が指摘されています。
その後も私たちは、線維芽細胞の増殖に関わる増殖因子を標的とした治療戦略の開発研究を継続しました。その中で注目されたのがマルチキナーゼ阻害薬BIBF1120です。
BIBF1120もイマチニブと同じく、当初は固形がん治療薬として開発された薬剤でしたが、PDGF、FGF(線維芽細胞増殖因子)、VEGF(血管内皮細胞増殖因子)刺激による肺線維芽細胞の増殖および遊走、ならびにTGF-βによって誘導される肺線維芽細胞の形質転換に対する抑制効果が見出されたことから,IPFの治療薬として臨床応用が期待されました。
このBIBF1120という開発コードで呼ばれた薬剤が後のニンテダニブです。私たちは
IPF患者を対象としたニンテダニブの第Ⅲ相臨床試験(国際共同治験)に参加しました。結果はpositiveであり、ニンテダニブはIPFの治療薬として、2014年10月に米国で、欧州では2015年1月に、我が国では2015年7月に承認されました。また、2015年のガイドライン改訂において、はじめてニンテダニブが記載され、「条件付き推奨(conditional recommendation for use)」と記載されるに至りました。
将来的により良い治療を目指すためには、より少ない量で、より高い抗線維化効果を発揮する薬剤を開発する必要があります。そこで次に私たちは、肺線維症におけるそれぞれの増殖因子の役割を検討し、より抗線維化作用に寄与している増殖因子受容体を選別、特定する研究を開始しました。
PDGF受容体は、PDGF受容体αとPDGF受容体βに細分化されます。そこで、PDGF受容体αとPDGF受容体βのそれぞれにのみ作用する特異的阻害薬を開発し、研究を行いました。その結果、PDGF受容体αではなく、PDGF受容体βの阻害が抗線維化効果に寄与していることを見出しました(
Kishi M et al. PLOS ONE. 2018)。そしてニンテダニブと比較して、イマチニブがPDGF受容体βを阻害するためには20~50倍ほど高い濃度が必要であり、この点も両薬剤の臨床試験における結果の明暗を分けた要因の一つであったと考えられました。
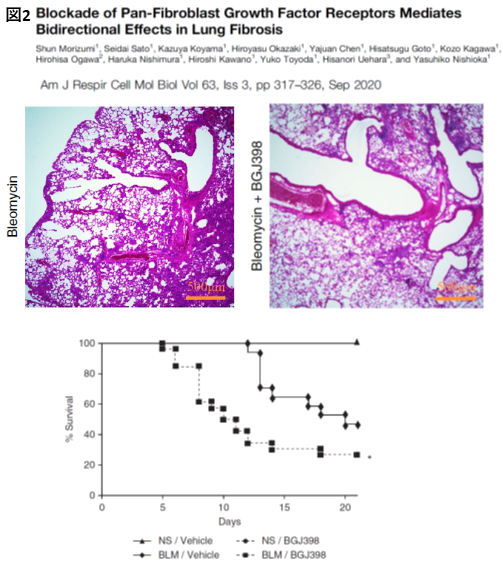
次に私たちは、ニンテダニブの作用点の一つとされているFGF受容体阻害が抗線維化効果に与える影響について検討しました。FGF受容体の特異的阻害薬を用いて検討を進めたところ、
in vitroの検討ではFGF受容体阻害は肺線維芽細胞の増殖および遊走を抑制しました。しかし、線維芽細胞のみならず肺胞上皮細胞にもFGF受容体が発現していたことから、肺線維症モデルマウスを用いた
in vivoの検討では、FGF受容体阻害は肺の線維化を抑制したものの、肺胞上皮細胞の傷害からの回復をも抑制してしまうことで、死亡率を逆に増加させてしまうという驚くべきことがわかりました(
Morizumi S et al. Am J Respir Cell Moll Biol. 2020)(図2)。ニンテダニブのFGF受容体阻害効果のIC50(半数阻害濃度)はヒトへの投与時における平均血中濃度よりもはるかに高く、実臨床におけるニンテダニブは、本当はFGF受容体を十分阻害していないとされています。私たちは、この研究結果がFGF受容体への阻害効果を有しながらもニンテダニブが臨床的成功をおさめた理由の一つではないかと考えています。
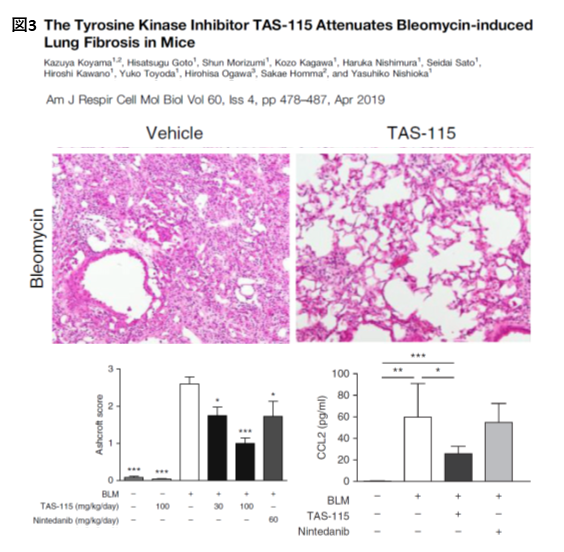
こうした研究結果を応用し、新たな治療戦略へと発展させるべく、次に私たちはPDGF受容体を選択的に阻害する一方でFGF受容体にはほぼ作用を有さない新規マルチキナーゼ阻害薬TAS-115を用いた研究を開始しました。TAS-115は肺線維症モデルマウスの線維化を抑制し、更に線維芽細胞の遊走因子であるマクロファージからのCCL2の産生をも抑制しました。これらの作用がいずれもニンテダニブと比較して強力であったことから、私たちはTAS-115がニンテダニブを上回る薬効を期待できる新規治療薬候補であることを報告しました(
Koyama K et al. Am J Respir Cell Mol Biol. 2019)(図3)。その後、私たちは
IPF患者を対象としたTAS-115の第Ⅱa相臨床試験に参加しました。TAS-115は第Ⅱb相臨床試験も計画されており、今後の臨床応用への発展が期待されます。
2.Fibrocyte研究
Fibrocyteは血球系と間葉系の性質を併せ持つ単球由来の間葉系前駆細胞です。その発見後、fibrocyteは、組織線維化を誘導することで創傷治癒に貢献する細胞と認識されてきました。しかし近年、血中fibrocyte数とIPF患者の早期死亡率との間の相関が報告されるなど、線維化肺におけるfibrocyteは、肺の病的線維化を促進する負の側面を持つことが認識されるようになりました。我々は線維化病態に重要な役割を果たしているfibrocyteを治療標的とした新規治療戦略の開発と、その臨床応用を目指して研究を進めています。
まず私たちは、fibrocyteの肺への遊走に重要な役割を果たすCXCR4-CXCL12 axisの阻害薬であるAMD3100を用いた検討を開始しました。その結果、AMD3100はfibrocyteの肺への遊走を阻害するとともに、抗線維化作用を示しました(
Makino H et al. J Med Invest. 2013)。更にfibrocyteの遊走因子としてPDGFが重要な役割を果たしていることが見出されました(
Aono Y et al. Am J Respir Cell Mol Biol. 2014)。
この結果は、fibrocyteがニンテダニブ等のPDGF受容体阻害薬の対象となりえる可能性を示唆していました。そこで私たちは、fibrocyteと増殖因子との関係性に加えて、ニンテダニブのfibrocyteへの影響を検討しました。検討の結果、ニンテダニブは単球からfibrocyteへの分化や、fibrocyteの遊走を阻害することでも線維化抑制に寄与していることが判明しました。さらにfibrocyteは単球や線維芽細胞に比して多量のFGFやPDGFを分泌し、周囲細胞に影響を与えうることも見出されました(
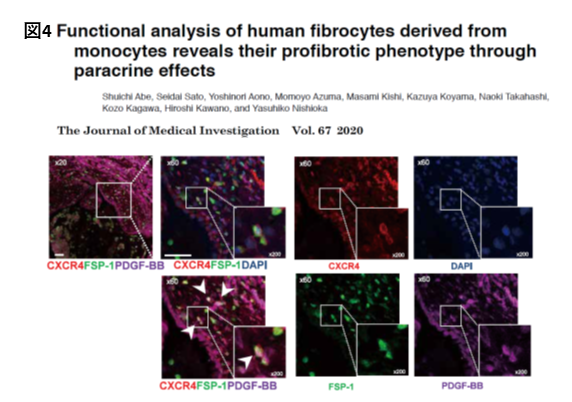
Sato S et al. Respir Res. 2017)。このようなfibrocyteによる増殖因子の産生を介した線維化促進への寄与は、実際のIPF患者肺を用いた検討でも確認されました(
Abe S et al. J Med Invest. 2020)(図4)。
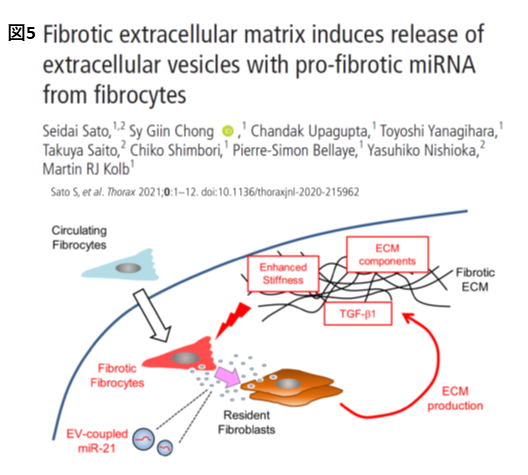
Fibrocyteは当初、骨髄から肺に遊走した後に、自ら肺線維芽細胞へ分化することで線維化促進に寄与すると考えられていました。しかし上記の検討等から、fibrocyteは様々な傍分泌因子を介して、周囲の細胞に影響を与えることでも線維化促進に寄与していることが分かりました。そこで次に我々は、fibrocyteによる増殖因子以外の傍分泌因子について検討を行いました。その結果、fibrocyteは線維化肺組織内で構築された異常な細胞外基質の影響を受けて、線維化促進性microRNAの発現量を変化させ、線維化を促進しているという新たなメカニズムが見出されました(
Sato S et al. Thorax. 2021)(図5)。
2018年にfibrocyteの分化抑制作用を有するペントラキシン2による治療が、IPF患者の肺機能減少を抑制するとした第Ⅱ相試験結果が発表され、新たな治療標的候補として大きな注目を集めています。IPF患者に対するペントラキシン2は現在、第Ⅲ相無作為化二重盲検プラセボ対照試験が計画されています。このように、今後、fibrocyteを標的とした戦略が、新たにIPF治療に組み込まれる可能性は大いにあり、私たちの行っているようなfibrocyteの線維化促進作用に着目した基礎研究の需要が高まっていると考えられます。
3.そのほかの新規薬剤開発
上記したほかにも、私たちのグループでは常に新たな着想をもって、肺線維症の新規薬剤開発を目指しています。
炎症性サイトカイン産生にかかわるシグナル伝達分子である転写因子NF-κB経路を阻害するIκB キナーゼ阻害薬IMD-0354による抗線維化効果や(Inayama M et al. Am J Respir Crit Care Med. 2006)、CCNファミリー分子であるCCN6がインテグリンβ1を介して肺線維芽細胞の増殖ならびに細胞外基質産生の増強効果を有するとした検討結果(Batmungh R et al. J Med Invest. 2011)、インテグリンシグナルの下流分子である接着斑キナーゼ(FAK)の阻害薬TAE226の抗線維化効果(Kinoshita K et al. Am J Respire Cell Mol Biol. 2013)、新規Wnt/β-catenin阻害薬であるPRI-724の抗線維化効果(Okazaki H et al. Exp Lung Res. 2019)などをこれまで報告しています。
4.IPFに対する他施設共同臨床試験・治験
私たちのグループでは、厚生労働科学研究班「びまん性肺疾患調査研究班」に参加し、IPFに対する医師主導の多施設共同臨床試験に参加するとともに、抗線維化薬開発の治験を実施しています。
ニンテダニブやTAS-115の治験については上述した通りであり、そのほかにも本邦で実施されたピルフェニドンの第Ⅲ相試験や、Nアセチルシステイン(NAC)吸入療法の医師主導臨床試験に参加した。最近ではIPFバイオマーカーの国際的探索研究(INMARK試験)(Maher TM, Stowasser S, Nishioka Y, et al. BMJ Open Respir Res. 2018)(Maher TM, Stowasser S, Nishioka Y, et al. Lancet Respir Med. 2019)や新規autotaxin阻害薬であるGLPG1690のIPF患者を対象とした第Ⅲ相試験に参加してきました。
現在でもIPF合併非小細胞肺癌に対する周術期ピルフェニドン療法の術後急性増悪抑制効果に関する第Ⅲ相臨床試験(NEJ034)や、特発性間質性肺炎に対する多施設共同前向き観察研究(JIPS Registry -NEJ030-)、多分野合議による間質性肺炎診断 に対する多施設共同前向き観察研究(Providing Multidisciplinary ILD diagnoses (PROMISE) study)に参加しています。
 良性肺疾患グループの研究は、間質性肺炎・肺線維症を中心とした間質性肺疾患の新たな治療戦略の開発が目的です。特に、進行性の肺機能低下を特徴とする難病指定疾患、特発性肺線維症(IPF)を重要な研究対象としています。現在IPFに対しては、従来から使用されてきたステロイドや免疫抑制薬による治療の有効性が否定され、肺胞上皮細胞と線維芽細胞を中心とした線維化仮説に基づき新たな抗線維化薬の開発が望まれています。
良性肺疾患グループの研究は、間質性肺炎・肺線維症を中心とした間質性肺疾患の新たな治療戦略の開発が目的です。特に、進行性の肺機能低下を特徴とする難病指定疾患、特発性肺線維症(IPF)を重要な研究対象としています。現在IPFに対しては、従来から使用されてきたステロイドや免疫抑制薬による治療の有効性が否定され、肺胞上皮細胞と線維芽細胞を中心とした線維化仮説に基づき新たな抗線維化薬の開発が望まれています。 各種の分子標的治療薬のスクリーニングを行った結果、私たちは最初の分子標的治療薬として開発された慢性骨髄性白血病の治療薬であるイマチニブには、フィラデルフィア染色体であるBcr-Ablのみならず、肺線維芽細胞の増殖因子であるPDGF受容体の阻害活性を有していることに着目し、その抗線維化効果を検討しました。その結果、イマチニブは肺線維芽細胞の増殖を抑制することで強力な抗線維化作用を示しました(Aono Y et al. Am J Respir Crit Care Med. 2005)(図1)。
各種の分子標的治療薬のスクリーニングを行った結果、私たちは最初の分子標的治療薬として開発された慢性骨髄性白血病の治療薬であるイマチニブには、フィラデルフィア染色体であるBcr-Ablのみならず、肺線維芽細胞の増殖因子であるPDGF受容体の阻害活性を有していることに着目し、その抗線維化効果を検討しました。その結果、イマチニブは肺線維芽細胞の増殖を抑制することで強力な抗線維化作用を示しました(Aono Y et al. Am J Respir Crit Care Med. 2005)(図1)。 次に私たちは、ニンテダニブの作用点の一つとされているFGF受容体阻害が抗線維化効果に与える影響について検討しました。FGF受容体の特異的阻害薬を用いて検討を進めたところ、in vitroの検討ではFGF受容体阻害は肺線維芽細胞の増殖および遊走を抑制しました。しかし、線維芽細胞のみならず肺胞上皮細胞にもFGF受容体が発現していたことから、肺線維症モデルマウスを用いたin vivoの検討では、FGF受容体阻害は肺の線維化を抑制したものの、肺胞上皮細胞の傷害からの回復をも抑制してしまうことで、死亡率を逆に増加させてしまうという驚くべきことがわかりました(Morizumi S et al. Am J Respir Cell Moll Biol. 2020)(図2)。ニンテダニブのFGF受容体阻害効果のIC50(半数阻害濃度)はヒトへの投与時における平均血中濃度よりもはるかに高く、実臨床におけるニンテダニブは、本当はFGF受容体を十分阻害していないとされています。私たちは、この研究結果がFGF受容体への阻害効果を有しながらもニンテダニブが臨床的成功をおさめた理由の一つではないかと考えています。
次に私たちは、ニンテダニブの作用点の一つとされているFGF受容体阻害が抗線維化効果に与える影響について検討しました。FGF受容体の特異的阻害薬を用いて検討を進めたところ、in vitroの検討ではFGF受容体阻害は肺線維芽細胞の増殖および遊走を抑制しました。しかし、線維芽細胞のみならず肺胞上皮細胞にもFGF受容体が発現していたことから、肺線維症モデルマウスを用いたin vivoの検討では、FGF受容体阻害は肺の線維化を抑制したものの、肺胞上皮細胞の傷害からの回復をも抑制してしまうことで、死亡率を逆に増加させてしまうという驚くべきことがわかりました(Morizumi S et al. Am J Respir Cell Moll Biol. 2020)(図2)。ニンテダニブのFGF受容体阻害効果のIC50(半数阻害濃度)はヒトへの投与時における平均血中濃度よりもはるかに高く、実臨床におけるニンテダニブは、本当はFGF受容体を十分阻害していないとされています。私たちは、この研究結果がFGF受容体への阻害効果を有しながらもニンテダニブが臨床的成功をおさめた理由の一つではないかと考えています。

 Fibrocyteは当初、骨髄から肺に遊走した後に、自ら肺線維芽細胞へ分化することで線維化促進に寄与すると考えられていました。しかし上記の検討等から、fibrocyteは様々な傍分泌因子を介して、周囲の細胞に影響を与えることでも線維化促進に寄与していることが分かりました。そこで次に我々は、fibrocyteによる増殖因子以外の傍分泌因子について検討を行いました。その結果、fibrocyteは線維化肺組織内で構築された異常な細胞外基質の影響を受けて、線維化促進性microRNAの発現量を変化させ、線維化を促進しているという新たなメカニズムが見出されました(Sato S et al. Thorax. 2021)(図5)。
Fibrocyteは当初、骨髄から肺に遊走した後に、自ら肺線維芽細胞へ分化することで線維化促進に寄与すると考えられていました。しかし上記の検討等から、fibrocyteは様々な傍分泌因子を介して、周囲の細胞に影響を与えることでも線維化促進に寄与していることが分かりました。そこで次に我々は、fibrocyteによる増殖因子以外の傍分泌因子について検討を行いました。その結果、fibrocyteは線維化肺組織内で構築された異常な細胞外基質の影響を受けて、線維化促進性microRNAの発現量を変化させ、線維化を促進しているという新たなメカニズムが見出されました(Sato S et al. Thorax. 2021)(図5)。